파이프라인 상세
FM101 (원발성 답즙성 담관염 치료제)
| 구분 | 내용 |
|---|---|
| FM101 |
|
| Indication |
|
| Unmet Needs |
|
| Efficacy |
|
| Market |
|
| Orphan Drug |
|
Indication
원발성 담즙성 담관염
원발성 담즙성 담관염은 담즙 정체를 특징으로 하는 자가면역성 질환으로 북미에서는 약 2500명 중 1명에서 보고되는 희귀질환입니다.
간 내 담관이 점차적으로 파괴되는 만성 질환으로, 간 내에 담즙이 축적되어 조직 손상과 흉터, 또는 섬유증이 원인이 되어 간경변을 유발합니다
Unmet Needs
현재,UDCA 와 Ocaliva가 1,2차 치료제로 사용되고 있으나, 약 40% 정도의 치료제 미반응 환자가 존재합니다.
해당 치료제는 소양증 및 만성피로 등의 부작용이 심해 새로운 치료제의 수요가 높습니다.
Orphan Drug



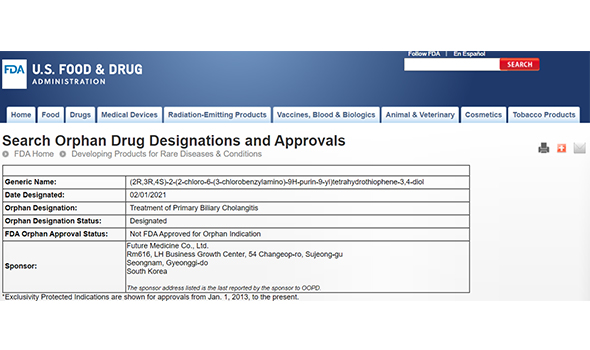


- FM101은 2021년 2월 USFDA로 부터 희귀의약품으로 지정받았습니다.
- FDA의 희귀의약품 지정 제도는 희귀·난치성 질병이나 생명을 위협하는 질병의 치료제 개발·허가가 원활히 이뤄질 수 있도록 지원하기 위해 세금 감면, 허가신청 비용 면제, 동일계열 내 최초 시판허가 시 7년간 독점권 인정 등 다양한 혜택을 부여합니다.










